世界初のミトコンドリア病治療薬「MA-5」の第2相臨床試験を開始 -難聴を有するミトコンドリア病患者を対象-
2025年11月19日
【発表のポイント】
【概要】
東北大学大学院医学系研究科および大学院医工学研究科の阿部 高明教授らのグループが開発したMA-5はこれまでの研究からミトコンドリア病のモデル動物に発症する症状(生存率低下、神経障害、腎機能障害、肝機能障害、運動障害等)の改善が認められました。また各種マウス難聴モデルやヒトiPS細胞由来内耳細胞を使った研究からMA-5は難聴に有効なことを明らかにしました。
これらの成果を踏まえ、阿部 高明教授、順天堂大学大学院医学研究科小児思春期発達・病態学/難治性疾患診断・治療学の村山 圭教授、東北大学病院耳鼻咽喉・頭頸部外科の本藏 陽平講師らの研究グループは、ミトコンドリア病ならびに難聴の治療薬としての承認を目指して難聴を伴うミトコンドリア病患者を対象とするMA-5の医師主導第2相臨床試験を、日本国内4つの医療機関で2025年12月から実施します。本研究によるMA-5の臨床開発は治療薬のない希少難病であるミトコンドリア病の進行抑制と同時に、国民の多くが悩まされている難聴の改善に寄与することが期待されます。
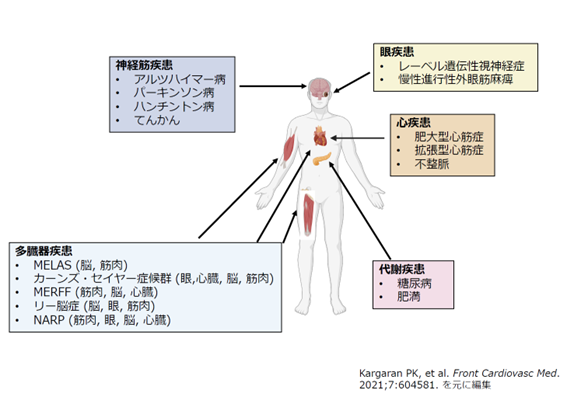
図1. ミトコンドリア病は小児期から全身の機能障害がおきる希少難病である。
【用語説明】
注1. ミトコンドリア病:生命活動に必要なエネルギーであるATPの約95%を産生するミトコンドリアの機能異常により引き起こされる疾患です。ミトコンドリアは全有核細胞に存在するために、脳、心臓、腎臓、膵臓など全身のあらゆる臓器に障害が起きます。
注2. 有効性:薬や治療法が期待される効果をどれだけ発揮するか。つまり、「その薬は本当に病気や症状を改善するのか」という治療効果の度合いのことです。
注3. 第2相臨床試験:新しい薬や治療法を開発する過程で行われる臨床試験(治験)の段階の一つです。対象疾患の少数の患者さんを対象に、薬の有効性(効果があるか)、安全性、そして最適な投与量などを調べることを目的とします。
注4. 治験:新薬や新しい治療法が人間に対して安全で効果があるかを確かめるための臨床試験です。厳格な基準と手順に従い、段階的に実施され参加者の同意が必須です。得られたデータから有効性、安全性、適切な用量などを評価し、医薬品承認の根拠とします。治験は実験室の研究から実際の医療現場への橋渡しとなる、医療発展に不可欠な科学的検証プロセスです。
注5. 安全性:薬や治療法を使用した際に生じる可能性のある副作用やリスクがどの程度あるか。「その薬はどれくらい安全に使えるのか」という観点から評価される指標です。
注6. 薬物動態:薬が体内でどのように吸収され、分布し、代謝され、排泄されるかという過程です。簡単に言えば「薬が体内でどのように動くか」を示すもので、薬の効き方や効き目の持続時間などに関わる重要な情報です。
詳しくは下記のPDFファイルをご覧ください。


